![]()
![]()
| 1,構造 | 結晶 結合1 結合2 電子の分布 |
| 2,熱 | 振動モード 格子振動 Einstein比熱 フォノン Debye比熱 逆格子ベクトル |
| 3,金属 | Fermi気体 Fermi分布 電気伝導 プラズマ振動 |
| 4,誘電体 | 分極 Lorentzの式 |
分子の配置にはいろいろありますが、次の4つは有名です。
| 名称 | sc | bcc | fcc | hcp |
| 図 | 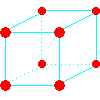 |
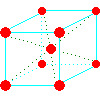 |
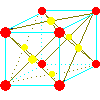 |
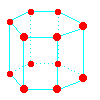 |
| 格子点数 | 1 | 2 | 4 | 4 |
| n,n | 6 | 8 | 12 | 5 |
| 2nd n,n | 12 | 6 | 6 | 6 |
| 一辺 | 2r | - | ||
| 基本体積 | 8r3 | 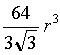 |
? | |
| 充填率 | 52% | 68% | 74% | ? |
| 例 | NaCl,CO2 | Fe,Ni | Cu,Au | ? |
※n,nとは、最近接格子点数のこと(最も近い分子の数)
※fccの原子の色が違っていますが、見やすくするためです。
![]()
ここでは、どのようにして原子同士が結合しているのかを考えます。
簡単のため、2つの水素原子が結合して、水素分子になっている場合を考えます。
水素分子を近づけていくとポテンシャルが下がります。(安定する)
これは、2つの原子間に電子があり、クーロン力によって結合します。
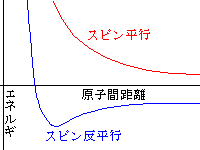
ところで、このときには電子同士が反平行、つまりスピンがお互いに反対になっている必要があります。
これは、パウリの排他原理というものです。
パウリの排他原理とは、以下のことです。
3つの量子数l,m,nで決まる1つの軌道に入りうる電子の数は2個である。
この2個というのは、スピンの2つの状態に2個という意味である。
このため、電子同士が反平行になっている必要があります。
もし、平行になっていると、電子同士がお互いをさけてしまい2原子間に
電子が存在しにくくなります。すると、原子同士が引き合わないので
結合できません。
![]()
結合には、以下の5種類があります。実際には、これらが組み合わさります。
金属原子の自由電子が自由に金属内を動き回ります。
そのために結合するというものです。
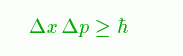
という不確定性原理があります。
電子が金属内を自由に動き回れるということは、Δxが大きいので
Δpが小さくなり、安定します。
塩化ナトリウム(食塩)などの結合です。
これらの分子には極性があるのでこちらの+と
あちらの-が引き合うということで結合します。
電子が、複数の原子に共有されることによって安定します。
先ほどの金属結合と同じで、Δxが大きい(金属ほどではないが)ので安定します。
ダイヤモンド、酸素、水素の結合がこれです。
先ほどのように原子同士の結合は以上の3つのどれかになっています。
それと違い、水素結合は分子同士の結合です。
水は、極性があり、図のように+と-ができます。
そして、分子同士で引き合うので安定するというものです。
分子には質量があるので、重力が働くというものです。
あまりにも質量が小さいのですが、接近しているため
分子レベルではわりと大きな力になります。
![]()
原子核の周りには電子の軌道があります。
軌道の名称は内側から、1s、2s、2p、・・・になっています。
s軌道には2個、p軌道には6個、d軌道には10個、f軌道には14個まで入れます。
| 元素 | K殻 | L殻 | M殻 | N殻 | O殻 |
| 1s | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f | 5s 5p 5d 5f | |
| H | 1 | ||||
| Be | 2 | 2 | |||
| Ne | 2 | 2 6 | |||
| Ar | 2 | 2 6 | 2 6 | ||
| Ca | 2 | 2 6 | 2 6 | 2 | |
| Fe | 2 | 2 6 | 2 6 6 | 2 | |
| Kr | 2 | 2 6 | 2 6 10 | 2 6 | |
| Ag | 2 | 2 6 | 2 6 10 | 2 6 10 | 1 |
| In | 2 | 2 6 | 2 6 10 | 2 6 10 | 2 1 |
| Cs | 2 | 2 6 | 2 6 10 | 2 6 10 | 2 6 |
Feなどは「遷移元素」といわれ、内側の殻が電子で満たされなくても
次の軌道に電子が入ります。
また、どの軌道も電子が2つで一組になっていてお互いに電子のスピンが
逆になっています。(パウリの排他律)
原子が単独で存在するときはこのような電子配置をとりますが、結晶では違ってきます。
例えばC(炭素)の場合、
| 単独 | 結晶 |
| 2p 2s |
2p 2s |
このように電子の配置が変わり、「混成軌道」になります。
この例では、s軌道に1個、p軌道に3個の電子があるのでsp3といいます。
他にもsp2、sp軌道があります。
 格子同士はバネのようなものでつながっていると考えることによって
格子同士はバネのようなものでつながっていると考えることによって
熱の伝導や比熱などが説明できます。
振動は、3次元的に考えると、縦波と横波があります。
物理では、縦波をL、横波をTとしています。
また2種類の原子からなる結晶では、
振動する時に2原子全体が振動する音響モードと
2原子間で振動する光学モードがあります。
物理では、音響モードをA、光学モードをOとかきます。
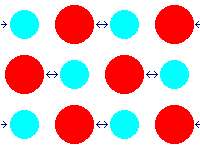
光学モードの振動の様子は右図の通りです。
![]()
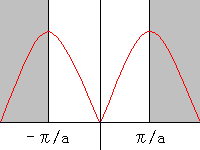
格子間の間の距離をaとします。このとき、波数qは
-π/a < q < π/a の範囲にあります。
下のグラフは、波数qとそのエネルギーの関係です。
![]()
Einsteinの比熱の式というのがあります。
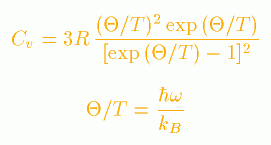 |
θ:Einsteinの特性温度 T:温度[K] R:気体定数 |
この式を解くと以下のようになります。
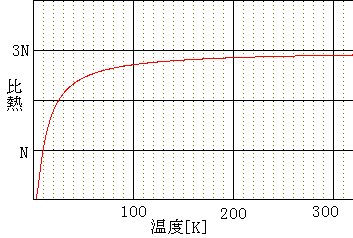
これから、低温では比熱は温度に比例して0に近づきますが
高温では、ほぼ一定で3Rに近づきます。
![]()
波は、量子的に考えると連続的なエネルギー分布をしていなく
とびとびの値を持ちます。このときの値は
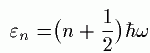
これは、光子(フォトン)に似ています。
フォノンの運動エネルギーは
![]()
で与えられます。
![]()
Einsteinの比熱の式は、低温部で実験値と違っていました。
これは、振動を余りにも簡単に考えたためです。
式は複雑になったのですがより実験値に近づいたのはDebyeの比熱の式です。
![]()
位置ベクトルをR、逆格子ベクトルをGとすると
exp(iG・R)=1 G・R=2πm m:整数
であるようなGを逆格子ベクトルといいます。
位置ベクトルRで面を表したとき、Gは面に垂直なベクトルになります。
長さは、λ=d(面間隔)のある波の波数(q)です。
G=u1b1+u2b2+u3b3 b1,b2,b3:互いに直交する
としたとき、u1,u2,u3はミラーの面指数に対応します。
ミラーの面指数は、(0,0,1)だと、法線がZ軸方向の面であるということになります。
金属の構造は、原子核が整然と並んでいて、自由電子が自由に金属内を飛び回っています。
これで不確定性原理より、自由電子の位置の大きさが大きいため、
運動量が小さくなりエネルギーが小さくなります。
自由電子同士が気体のようにお互いに相互作用がないものとして考え、
Fermi気体と名付けました。
波数kは、一辺がLの立方体で考えると
ki=2πli li:量子数 0,±1,±2・・・ L
1つの量子状態はk空間で
(2π)3 V:立体の体積 V
になります。 k空間でもkは最大値KFまでしかとれないので、半径kFの球の中に
先ほどの量子状態が詰まっていくといったイメージです。
また、KFから、エネルギーのEFがもとまって
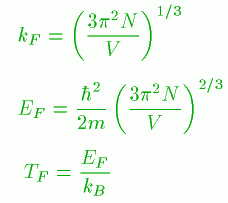
このTFというのはFermi温度といいます。
計算値では数万度になりますが、金属にさわってもやけどすることはありません。
これは、低いエネルギーは満杯になっているため、熱エネルギーを外部に
放出してエネルギーを低くすることができないためです。
![]()
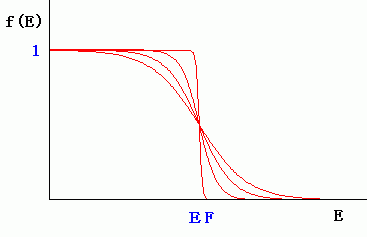
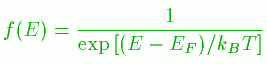
もし、T→0の極限ではE>EFでは
f(E)=0、E<EFでは、f(E)=1
になります。Tが大きくなると、この条件が
ぼやけてきます。右図では、Tが0に近いとき
階段関数に近くなっていますが
Tを大きくするとだんだんなめらかに
なっていきます。つまり、絶対0度では
EF以内に電子のエネルギーがぴったり収まって
いるのですがTを大きくすると、EFよりも
大きなエネルギーを持つことができます。
その分、EFより小さい部分では空席ができます。
これより電子比熱が求まって、
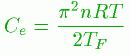 |
n:原子の電子価 |
![]()
電流は、導体内の電場によって加速されます。
しかし、加速すると原子や格子欠陥の部分と衝突して散乱されます。
これによって、電子は等速度運動をします。これは空中を落下する雨に似ています。
雨は重力によって加速されるのですが空気抵抗によって減速され、両者が釣り合うところで
平衡状態(等速度運動)になります。だから雨に当たってもけがをすることはありません。
電気伝導度σは以下のようにして定義されています。
σ=j j:電流密度 E E:導体内の電場 =neτ n:自由電子の密度 m:電子の質量 m τ:平均衝突時間 =ρ-1 ρ:抵抗率
電流密度とは1㎡を垂直に流れる電流のことです。
τは、ある原子に衝突してから次の原子に衝突するまでの平均時間です。
電気伝導度は大きければ、電気を通しやすく(抵抗が小さい)ρは
R=ρl S
で、でてきたもので、大きければ電気を通しににくいです。
![]()
金属では、原子が自由電子の海に浮いてると考えることもできます。
電子の海は波があります。(波は電子の密度の変化で、それによって電場ができます。)
これは、格子振動に似ています。格子振動の波はフォノンといいましたが
今回の場合はプラズモンといって
hωp ωp:角速度
単位のエネルギーを持ちます。
誘電体に電界をかけると分極という現象が起きます。
金属をちがって、電子は自由に移動できないので誘電体内部には電界が存在します。
分極は、大きく分けて3種類あります。
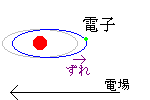 電子分極とは、電場によって電子の軌道が元の軌道からずれます。
それによって、+の原子核と-の電子に偏りができて分極が起きます。
この双極子モーメントを
電子分極とは、電場によって電子の軌道が元の軌道からずれます。
それによって、+の原子核と-の電子に偏りができて分極が起きます。
この双極子モーメントを
m=αE α:分極率 m:双極子モーメント E:電場
とおけます。電気分極をベクトルPで表すと
P=Nm N:分子の数
これは、双極子mがN個あるのでN倍にしただけです。 誘電率εとの関係は
ε=1+4πP P:分極 E E:電場 ε:誘電率 =1+4πNα α:分極率
αは物質ごとに決まっていて
| 物質 | α | 物質 | α |
| He | 0.201 | Ne | 0.390 |
このαですが2原子になると、分子に対する電場の向きによってαが変わってきます。
分子に水平な電場がかかったときのαをα(//)、垂直なときをα(⊥)とすると
| 物質 | α(//) | α(⊥) |
| H2 | 0.93 | 0.72 |
| O2 | 2.35 | 1.21 |
| N2 | 2.38 | 1.45 |
通常、分子の向きはそれぞれまちまちなので
α=α(//) + 2α(⊥) 3 3
で決まります。
イオン結晶で結びついているものは電場をかけることによって分極します。
ただし、イオン分極は電子分極と比べて1/10程度しかありません。
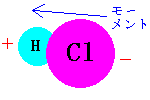 HClのようなものは電場をかけていなくても、Hの電子がClに引き寄せられます。
HClのようなものは電場をかけていなくても、Hの電子がClに引き寄せられます。
従って、電子内部に電場に関係なくモーメントができます。
このような分子を「極性分子」といいます。
反対にCO2は、分極の作用が分子内で打ち消しあっているので
「無極性分子」といいます。
配向分極のモーメントをμであらわすと、平均値<μ>と
これから分極Pと誘電率εが求まって
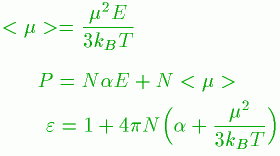 |
T:温度 E:エネルギー |
以上のように3つの分極があります。
そのうち、「電子分極」と「イオン分極」を「誘起双極子モーメント」
「配向分極」を「永久双極子モーメント」といいます。
![]()
これは、誘電体の電場をFで表したものです。
F=F1+F2+F3
からFを求めることができます。
F1は誘電体外部の電場、F2は誘電体表面の電荷、F3は誘電体内部の電荷です。
例えば、電場の中に分極Pの双極子があった場合F1=E、F2=4πP/3、F3=0なので、
F=E+4πP 3
になります。εは誘電体がない場合と比べて大きくなります。